Una de las primeras descripciones macroscópicas del movimiento browniano fue hecha en 1908 por el físico francés Paul Langevin. Él hizo las siguientes consideraciones: si una partícula grande (comparada con las dimensiones atómicas) se introduce en un fluido, entonces, de acuerdo con la hidrodinámica, va a experimentar una fuerza opuesta que depende de su velocidad. Como ejemplo de este hecho podemos mencionar el caso de un auto o de un aeroplano que se mueven: el aire genera una fuerza que se opone al movimiento; o cuando nadamos en una alberca: el agua se opone a nuestro movimiento. Esta fuerza de oposición se debe a la viscosidad del fluido. Mientras mayor sea la velocidad con que se mueve el cuerpo dentro del fluido, mayor será la fuerza de oposición, o de fricción viscosa, que se genere.
Por otro lado, de lo descrito anteriormente se sabe que al introducir una partícula grande dentro de un fluido, aquélla experimenta fuerzas debidas a las colisiones que sufre con las moléculas del fluido. En vista de la gran cantidad de colisiones que ocurren en cada instante, esta segunda fuerza varía de una forma muy azarosa y violenta. Ello significa que si, por ejemplo, hacemos observaciones de la partícula browniana con una escala de tiempo del orden de los segundos la fuerza debida a las colisiones variará mucho, pues en un segundo habrán ocurrido muchísimas colisiones. Por otro lado, en esta misma escala de tiempo, la primera fuerza de la que hemos hablado, la de fricción, varía muy poco.
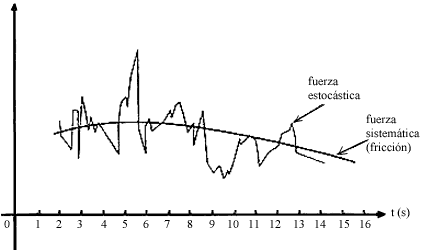
La siguiente imagen muestra que las fuerzas estocástica y viscosa que experimenta la partícula browniana varían en diferentes escalas de tiempo.
De esta manera, se reconocen dos escalas de tiempo muy distintas: la escala en la que varía la fuerza de fricción (que es, para casos típicos, del orden de segundos) y la escala en la que varía la fuerza debida a las colisiones (que es del orden de milésimas de microsegundo). Esto significa que si observamos los fenómenos con escalas de tiempo de segundos, la fuerza de fricción apenas cambia, mientras que la otra fuerza ya habrá cambiado muchísimas veces.
Ahora bien, si se conoce la velocidad de la partícula, la fuerza de fricción también se puede determinar: es proporcional a ella. Es decir, si la velocidad aumenta al doble, la fuerza se duplica; si la velocidad se triplica la fuerza aumenta al triple, etcétera. El coeficiente de proporcionalidad entre la fuerza y la velocidad depende de la viscosidad del fluido así como de la forma geométrica de la partícula. Estas dependencias son conocidas aunque no las daremos aquí. Además, el sentido que tiene la fuerza es opuesto al de la velocidad ya que aquélla se opone al movimiento (Figura 11). En otras palabras, es posible determinar completamente esta fuerza en cada instante. En la teoría del movimiento browniano se suele llamar fuerza sistemática a esta fuerza de fricción.
Otra cosa ocurre con la fuerza debida a las colisiones. Dado que en un segundo el número de colisiones que experimenta la partícula browniana con las del fluido es enorme, resulta prácticamente imposible determinar el valor exacto de esta fuerza en cualquier instante. Por la misma causa, este valor varía en pequeños intervalos, de manera impredecible. Estamos entonces ante una situación en que una de las fuerzas que experimenta la partícula browniana varía de manera azarosa; es decir, se tiene una fuerza fluctuante. En matemáticas este tipo de cantidad recibe el nombre de estocástica.
La siguiente imagen, hace referencia a que La fuerza viscosa tiene sentido opuesto a la velocidad de la partícula.
Bibliografía:
Eliezer Braun. (1986). Un movimiento en Zigzag. México: Fondo de Cultura Económica.