1) Toda la materia está constituida por pequeñas partículas llamadas moléculas.
Las propiedades químicas de las moléculas dependen de su composición, mientras que las propiedades físicas dependen de las fuerzas que las moléculas ejercen entre sí y de la distancia que las separa.
2) Las moléculas se encuentran en continuo movimiento. El promedio de la energía cinética de las moléculas depende de la temperatura.
3)Las moléculas obedecen las leyes del movimiento de Newton. En los choques entre las moléculas, su momento lineal y su energía cinética no cambian. Dichos choques son elásticos.
Para gases:
2. Se mueven en línea recta aleatoriamente obedeciendo las leyes de la
mecánica clásica.
3. Las colisiones perfectamente elásticas son el único tipo de interacción
que presentan estas partículas.
La imagen lateral muestra el comportamiento de las moléculas de gases, observamos como simulan moverse en línea recta aleatoriamente.
La imagen lateral muestra el comportamiento de las moléculas de gases, observamos como simulan moverse en línea recta aleatoriamente.
Para sólidos:
1. Las moléculas se encuentran cercanas entre sí.
2. Las fuerzas de atracción frecuentemente originan arreglos ordenados.
3. Los movimientos moleculares están sumamente restringidos, y consisten principalmente en vibraciones alrededor de puntos fijos.
Con ayuda de la siguiente imagen, podemos apreciar como las moléculas de un sólido están unidas de manera ordenada, ya que en estado sólido la fuerza de atracción es fuerte provocando este fenómeno.
Con ayuda de la siguiente imagen, podemos apreciar como las moléculas de un sólido están unidas de manera ordenada, ya que en estado sólido la fuerza de atracción es fuerte provocando este fenómeno.
Para líquidos:
1. Las moléculas se mantienen a distancias similares a las del estado sólido.
2. Se mantienen unidas por fuerzas atractivas débiles, esto permite que adopten la forma del recipiente que los contiene.
La imagen anterior nos ayuda a entender como se encuentran las moléculas del agua, ya que tienen una fuerza de atracción menor a la fuerza de atracción de los sólidos; además de que estas moléculas en estado líquido pueden adoptar la forma del recipiente en que se encuentren.
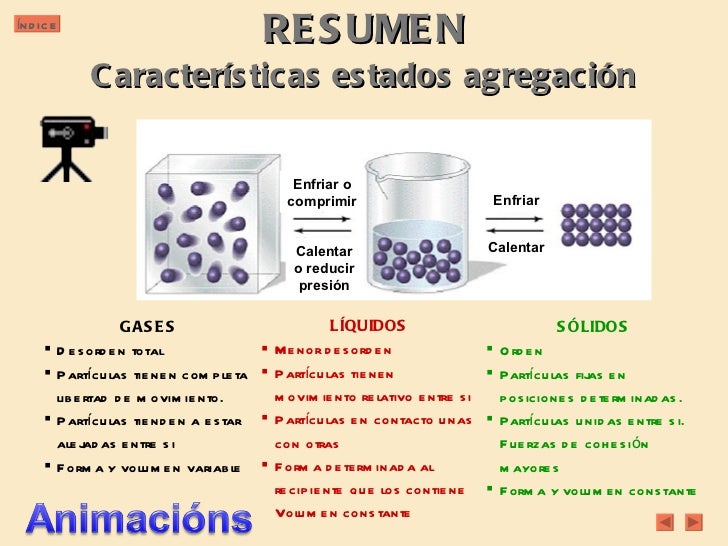
La siguiente imagen nos muestra las características que tienen las moléculas en los estado de agregación, gaseoso, líquido y sólido.
El siguiente vídeo nos explica de igual manera los postulados de la teoría cinética de la materia. (El video fue tomado de Youtube con el siguiente link https://www.youtube.com/watch?v=G300mQ59FE4) .
La imagen anterior nos ayuda a entender como se encuentran las moléculas del agua, ya que tienen una fuerza de atracción menor a la fuerza de atracción de los sólidos; además de que estas moléculas en estado líquido pueden adoptar la forma del recipiente en que se encuentren.
La siguiente imagen nos muestra las características que tienen las moléculas en los estado de agregación, gaseoso, líquido y sólido.
El siguiente vídeo nos explica de igual manera los postulados de la teoría cinética de la materia. (El video fue tomado de Youtube con el siguiente link https://www.youtube.com/watch?v=G300mQ59FE4) .
Bibliografía:
Enciclopedia de Conocimientos Fundamentales UNAM - SIGLO XX1, volumen 5, pag: 471
https://www.youtube.com/watch?v=G300mQ59FE4







.jpg/245px-Robert_Brown_(botanist).jpg)



