Ley
de Boyle
Robert
Boyle (1627-1691), quien estableció por primera vez sobre la base de sus
propios experimentos.

Para una cantidad determinada de gas, se encuentra experimentalmente que, a una buena aproximación el volumen de un gas es inversamente proporcional a la presión absoluta que se aplica cuando la temperatura se mantiene constante. Esto es
V a 1 ¤ P
Retrato de Robert Boyle--->
Retrato de Robert Boyle--->
La
ley de Boyle también se escribe
PV=constante [T constante]
Esto
es, a temperatura constante, si se permite que la presión o el volumen del gas
varíe, la otra variable también cambia de modo que el producto PV permanece
constante.
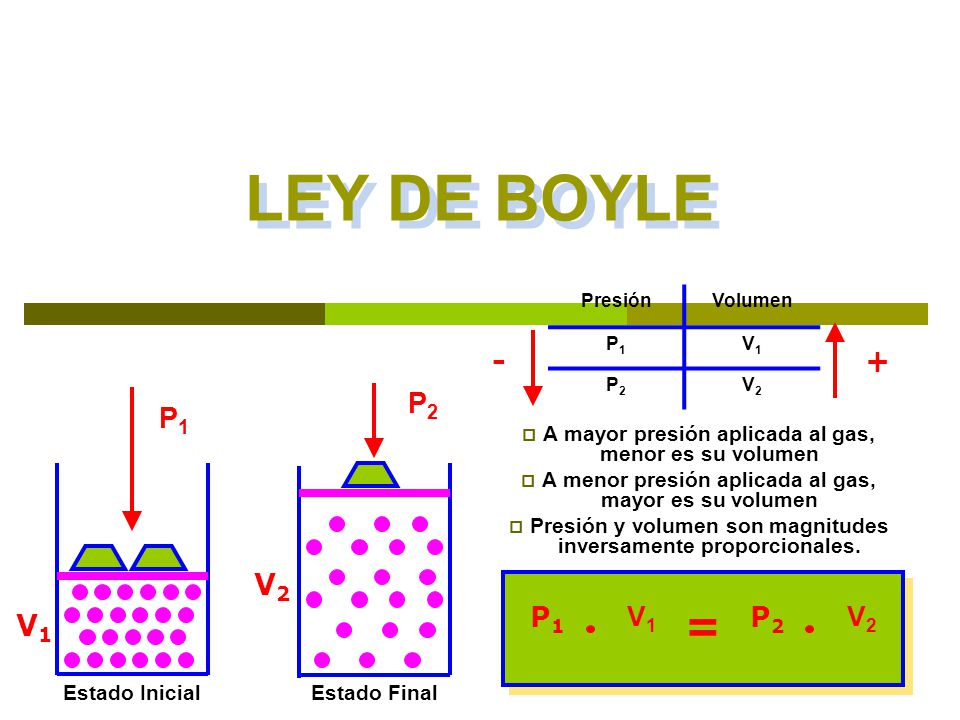
Relaciona inversamente las proporciones de presión y volumen de un gas, manteniendo la temperatura constante, (que es otra manera de expresar la Ley de Boyle)
Relaciona inversamente las proporciones de presión y volumen de un gas, manteniendo la temperatura constante, (que es otra manera de expresar la Ley de Boyle)
P1xV1=P2xV2
En la siguiente imagen se muestra la Ley de Boyle:
Mientras tanto, en el siguiente vídeo tomado de Youtube (con la siguiente liga https://www.youtube.com/watch?v=vq3-tk1xDo0&feature=youtube_gdata_player) podemos apreciar de mejor manera la "Ley de Boyle".
Mientras tanto, en el siguiente vídeo tomado de Youtube (con la siguiente liga https://www.youtube.com/watch?v=vq3-tk1xDo0&feature=youtube_gdata_player) podemos apreciar de mejor manera la "Ley de Boyle".
Ley
de Charles
El
francés Jacques Charles (1746-1823) descubrió en el año 1787 la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía. Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
 |
| Jacques Charles |
En la siguiente imagen podemos ver como se representa la Ley de Charles, pues al aumentar la temperatura el volumen también aumenta y al disminuir la temperatura el volumen también disminuía.
Del portal de vídeos de Youtube, se tomo un vídeo referente a la "Ley de Charles" (https://www.youtube.com/watch?v=1ZduXmVPe1I&feature=youtube_gdata_player).
Ley de Gay-Lussac

Joseph Gay-Lussac físico fránces(1778-1850), afirma que a volumen constante, la
presión absoluta de un gas es directamente proporcional a la temperatura
absoluta:
P a T
Lussac observó que los gases se expanden a una misma fracción de volumen para un mismo aumento en la temperatura, lo que le reveló la existencia de un coeficiente de expansión térmica común.
La ley de Gay- Lussac establece que la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
La imagen anterior representa la Ley de Gay- Lussac.
Con ayuda del siguiente vídeo se comprenderá de mejor manera la "Ley de Gay- Lussac", dicho vídeo fue tomado de Youtube (con el siguiente link: https://www.youtube.com/watch?v=OJ9_mgkwZAk&feature=youtube_gdata_player) :
La ley del gas ideal
Las
leyes de los gases de Boyle, Charles y Gay-Lussac se obtuvieron mediante una
técnica que es muy útil en ciencia: a saber, mantener una o más variables
constantes para ver con claridad los efectos del cambio en una de ellas sobre
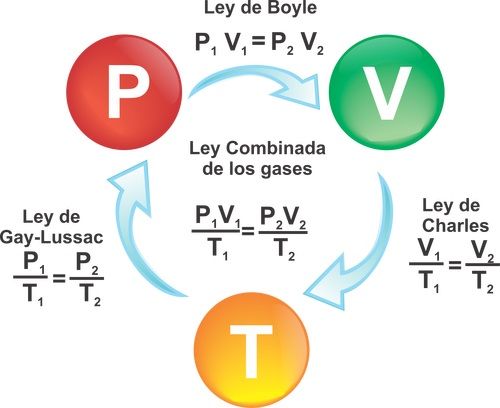
la otra. Ahora se pueden combinar estas leyes en una sola relación más general
Entre la presión absoluta, el volumen y la temperatura absoluta de una cantidad fija de gas:
Entre la presión absoluta, el volumen y la temperatura absoluta de una cantidad fija de gas:
PV a T.
Esta
relación indica cómo variará cualquiera de las cantidades P, V o T cuando
varíen las otras dos. Esta relación se reduce a la de Boyle, a la de Charles o
a la de Gay-Lussac cuando la temperatura, o la presión, o el volumen,
respectivamente, se mantiene constante.
Con la siguiente imagen podremos ver la relación que hay entre las 3 leyes mencionadas anteriormente.
Con la siguiente imagen podremos ver la relación que hay entre las 3 leyes mencionadas anteriormente.
Bibliografia:
Giancoli Douglas. (2006 ). FISICA. Principios
con aplicaciones. México: PEARSON.
https://www.youtube.com/watch?v=vq3-tk1xDo0&feature=youtube_gdata_player
https://www.youtube.com/watch?v=1ZduXmVPe1I&feature=youtube_gdata_player
https://www.youtube.com/watch?v=OJ9_mgkwZAk&feature=youtube_gdata_player
https://www.youtube.com/watch?v=vq3-tk1xDo0&feature=youtube_gdata_player
https://www.youtube.com/watch?v=1ZduXmVPe1I&feature=youtube_gdata_player
https://www.youtube.com/watch?v=OJ9_mgkwZAk&feature=youtube_gdata_player


Excelente trabajo. Las imágenes concuerdan el contenido y está bien sintetizada la información. Para mí fue muy fácil entender el contenido del mismo, puesto que, los ejemplos, las ilustraciones y el texto embonaban perfectamente. Muy bien.
ResponderBorrar¡Gracias! nos alegra saber que haya sido de tu agrado. :D
Borrar